碘
| 本元素尚未参照元素專題之格式編寫。 |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外觀 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
带金属光泽的紫灰色,蒸汽为紫色  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概況 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 碘(Iodine)·I·53 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素類別 | 卤素 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
族·週期·區 | 17 ·5·p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 標準原子質量 | 126.90447 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子排布 | [氪] 4d10 5s2 5p5 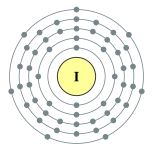 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 歷史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 發現 | 伯纳·库图瓦(1811年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分離 | 伯纳·库图瓦(1811年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物態 | 固态 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 4.933 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點 | 386.85 K,113.7 °C,236.66 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸點 | 457.4 K,184.3 °C,363.7 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 三相點 | 386.65 K(113 °C),12.1 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 臨界點 | 819 K,11.7 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化熱 | (I2) 15.52 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化熱 | (I2) 41.57 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比熱容 | (I2) 54.44 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸氣壓((正交))
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化態 | 7, 5, 3, 1, -1 (强酸性) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電負性 | 2.66(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電離能 | 第一:1008.4 kJ·mol−1 第三:3180 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半徑 | 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共價半徑 | 139±3 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 范德華半徑 | 198 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 雜項 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶體結構 | 正交 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 抗磁性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電阻率 | (0 °C)1.3×107 Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱導率 | 0.449 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 體積模量 | 7.7 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS號 | 7553-56-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最穩定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:碘的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
碘是卤族化学元素,化学符号是I,原子序数是53。
目录
1 性质
1.1 物理性质
1.2 化学性质
1.2.1 氧化性
1.2.2 还原性
2 發現
3 名稱由來
4 用途
4.1 主要用途
4.2 特殊用途
5 同位素
6 對人體的影響
6.1 人類營養問題
6.2 碘缺乏
6.3 碘過量
6.4 人體含量與分佈
6.5 吸收、儲存與排泄
6.6 生理與生化功能
6.7 食物來源
6.8 需要量評估方法
6.9 建議攝取量
7 參見
8 参考资料
性质
物理性质

碘可以升华成为紫色的气体。
碘在常溫下是紫色的固體,並會釋放出紫色的氣體。碘會昇華,但並不代表碘在常壓下並沒有液態(砷是唯一在常壓下沒有液態的元素),其昇華的原因是其固相時蒸氣壓足夠。碘在常壓下的熔點為114℃。
在20℃时,碘在水中的溶解度为0.03g/100g。[1]
碘溶于苯,乙醇,乙醚,氯仿,四氯甲烷中。[1]
化学性质
碘可以在氢氧化钠溶液中發生自身氧化還原反應。
3I2 + 6NaOH → 5NaI + NaIO3 + 3H2O
过量的碘单质还可以和反应产生的碘化钠进一步反应,产生无色的NaI3。所以并不能认为碘与强碱反应产生的无色溶液一定为-1价碘化物和碘酸盐的混合物
氧化性
碘是一种温和的氧化剂,可以和一些金属反应,如:
- I2 + Mn → MnI2
- I2 + Fe → FeI2
也能和一些强还原剂反应,如硫化氢或联氨[2]:
- 8 I2 + 8 H2S → 16 HI + S8
- 2 I2 + N2H4 → 4 HI + N2
还原性
碘和强氧化剂反应,可以被氧化,如:
- I2 + Cl2 → 2 ICl
氯气过量,可以进一步反应,生成三氯化碘:
- ICl + Cl2 → ICl3
此外,碘还可以被浓硝酸氧化。
發現
碘是在1811年被伯納·庫圖瓦(Barnard Courtois)在製造硝酸鉀時發現的。碘分子在酸性環境中比較穩定。
名稱由來
英文名稱Iodine來自希臘文ιώδης,意为靛色或紫色。日文則音譯德文Iod的第一個發音而稱之為「沃素(ヨウ素)」。而中文則取英文名稱的最後一個音節(dine→典),加上代表固體非金屬元素的「石」字部首,命名為「碘」。
用途
主要用途

碘-澱粉複合物的稀溶液。
- 碘是生物必須的一種微量元素,缺乏碘會引致碘缺乏病,影響甲狀腺。所以在日常飲食中得不到足夠碘的人要补充加碘鹽(通常是碘酸鉀)。
碘酊(又称碘酒,为碘和碘化鉀的酒精溶液)、碘仿與及聚維酮碘溶液是多用途的消毒劑。
碘131可用於醫學造影及放射治療,而不少醫學顯影劑均為含碘的有機化合物。- 一些國家會向核電廠週邊居民發放碘片(碘化鉀),在核事故發生四小時內服用,以降低甲狀腺吸收放射性同位素碘131。
- 一些攝影用的胶卷用碘化银作為感光材料。
卤素灯泡中含有碘或溴,以減緩燈絲燒毀的速度。
特殊用途
- 碘遇淀粉,会产生歧化反应,生成物呈蓝色,由此验证淀粉的存在。
- 碘單質是溫和的氧化劑,適合用作有機合成,例如卤仿反应。
- 同樣道理,碘離子也是種溫和的還原劑,能參與桑德迈尔反应。
- 碘能和碳碳雙鍵及三鍵發生加成反應。油脂化學方面用此反應測量碘价。
- 分析化學上廣泛採用碘量法來測定氧化劑和還原劑的當量。
- 由於碘單質的脂溶性較強,碘蒸氣可以使隱藏的指紋顯露。
碘化氮是一種沒有實用價值,但偶爾用於科普示範的炸藥。
碘化銀常用於人工降雨。
液流電池的電解質常含有碘離子。- 含碘離子的母液或防凍劑能跟蛋白質晶體結合,為X-射線繞射提供相位資訊[3]。
同位素
碘有三十三種同位素,半衰期小于一天的同位素有27种,只有碘-127是穩定的。含放射性的碘-131可以用來治療癌症,例如甲状腺癌。
對人體的影響
人類營養問題
碘是人體必需的元素,用以製造甲狀腺素以調控細胞代謝、神經性肌肉組織發展與成長(特別是在出生胎兒的腦部)[4]。碘缺乏症[5][2]是造成可避免性腦損害疾病最常見的因素,全世界估計有五千萬人深受影響。根據英國地質學勘查協會(British geological survey)關於IDD的調查:全球碘攝取不足的人口估計有20億,其中學齡兒童有2億8千5百萬[6];其中呆小症(cretinism)約570萬人,腦部損害(brain damage)2600萬人,甲狀腺腫(Goiter)6億5500萬人[7];這些人口則主要集中於中非、東南亞、中亞、中歐、東歐等地
碘缺乏
懷孕期間嚴重的碘缺乏會損害胎兒發展,對腦部發育的傷害最為嚴重,可導致智商明顯低落,因為胎兒與新生兒時期神經組織髓鞘化作用最活躍,並且受甲狀腺素控制。缺碘嚴重者造成呆小症(cretinism)、流產、死胎。其他慢性碘缺乏較普遍的影響有神經性肌肉不足、認知低下。初期的臨床症狀是甲狀腺體積增大,因缺碘反而增加甲狀腺攝取這血液中的碘的效能,是對缺碘補償反應,最後會在脖子形成可見的腫塊,稱甲狀腺腫(Goiter),可用觸診或超音波掃描法診斷,這也是世界衛生組織(WHO)之國際碘缺乏防治小組所推薦的碘營養評估指標之一。
碘缺乏時會導致TSH升高,這是因為甲狀腺素無法合成,又不斷利用負回饋機制刺激促甲狀腺激素(TSH)分泌所造成。
碘過量
碘過量會有以下症狀:甲狀腺炎(thyroiditis)、甲狀腺腫(Goiter)、甲狀腺機能不足或亢進、乳頭狀甲狀腺癌、過敏反應…。碘攝取過量時,甲狀腺機能反而受損,初期反應是血中促甲狀腺激素(thyroid stimulating hormone,TSH)高於正常值;攝取量高達750 μg/d時,TSH濃度明顯上升。由於TSH濃度升高反映甲狀腺機能有不足的危險,因此在碘攝取充足條件下,以血漿TSH濃度升高作為碘過量危害之指標,缺碘導致的TSH上升則不列入考慮。
中國對碘营养监测和碘盐质量检测结果显示,多数省级行政区的平均尿碘值已经高于世界卫生组织推荐的适宜水平,因此不缺碘地区特别是沿海的高碘地区要尽量少食用海带(每1000克干海带含碘240mg,而成人每日碘摄取量上限为1mg),紫菜(每1000克干紫菜含碘180mg)等含碘量高的食物,这样可以预防碘过量疾病的发生。[8]
人體含量與分佈
成人體內約含碘25~36 mg,大部分的碘集中在甲狀腺(thyroid)內供合成甲狀腺素(thyroxine)之用,正常的情況下約有15~20 mg,但在缺碘的情況下則可能少於20 μg。人體內的甲狀腺素由三碘甲狀腺原氨酸(T3,triiodothyronine)與四碘甲狀腺原氨酸(T4,tetraiodothyronine)組成,其中碘分別佔了59%與65%。除了甲狀腺外,其餘少部分碘則分佈於肌肉、皮膚、血液和中樞神經系統等組織中。
吸收、儲存與排泄
攝取進體內的碘有的是和胺基酸結合;或是以游離狀態如碘酸根(IO3−)以及碘離子(I−)形式存在。碘酸根在人體內可被谷胱甘肽還原成碘離子。碘離子的形式在人體的吸收效率很好,大部分都能在消化道被吸收。而和胺基酸結合以及其他有機形式的碘也能被吸收,但效率較差。吸收之碘以碘離子(I−)狀態存在血中,送至甲狀腺儲存,以用來合成甲狀腺素。食物中的甲狀腺素T4及T3可直接吸收,因此醫藥上能直接口服T4,作為缺乏甲狀腺素的治療方式。
因為腎臟沒有保留碘離子的機制,多餘的碘多從尿液排出,少數從糞便以及汗水排出。
生理與生化功能

甲状腺激素合成过程图解
碘最主要的功能即是合成甲狀腺素。甲狀腺素是一種重要的荷爾蒙,主要功能是促進代謝,刺激組織生長、成熟和分化,加快心跳,增加心輸出量等。許多其他荷爾蒙需要協同甲狀腺素才能達到有效的作用,例如在幼年發育過程中,生長激素和甲狀腺素共同作用才能使幼童正常生長發育。甲狀腺素有thyroxine(T4)和triiodothyronine(T3)兩種形式,血中以T4濃度較高,但活性以T3較高。另有一種reverse T3(rT3),是不具活性的代謝產物。不同的脫碘酶(5'-deiodinase、5-deiodinase)可將T4轉換成T3以及rT3,藉此調控甲狀腺素在體內的活性。
甲狀腺由許多囊泡組成,內充滿膠狀蛋白質,囊泡外圍是一層甲狀腺細胞。甲狀腺細胞將碘離子經由
鈉鉀幫浦,消耗ATP,送到細胞內並氧化成碘(I)。接著碘和甲狀腺球蛋白(thyroglobulin)上的酪氨酸殘基結合,形成monoiodotyrosine(MIT),再加上一個碘則形成diiodotyrosine(DIT)。在囊泡中,兩個DIT偶合形成T4<圖>;DIT和MIT偶合則形成T3<圖>。此時T4以及T3都還結合在甲狀腺球蛋白上,等到要釋出的時候,整個複合體會送到甲狀腺細胞,甲狀腺球蛋白會在細胞中被水解,T4以及T3便可被釋放到血液中。血液中,T4和T3大多結合在運輸蛋白上,送到目標組織,進入目標細胞的細胞核中,促進或抑制基因表現,達到控制細胞生長代謝的目的。
食物來源
人體所需的碘大部分來自飲食,諸如:海苔、海帶、龍蝦、貝類、綠色蔬菜、蛋類、乳類、穀類等[9],其中以海帶、海藻等食物含碘量最為豐富。預防碘之缺乏可採取食品加碘強化的措施,在食鹽中添加適量之碘化鉀(potassium iodide)、碘酸鉀(potassium iodate)等來補充碘的攝取。世界衛生組織建議每千克食鹽可添加20至40毫克碘質。国际食品法典委员会(Codex Alimentarius Commission)的食鹽標準中有關碘化食鹽(iodinated salt),建議各國衛生當局應評估當地碘質缺乏的情況,以制訂食鹽中最高及最低的含碘量。WHO/FAO食品添加物聯合專家委員會(JECFA)評估了碘的安全性,建議碘的暫定每日最高容許攝入量為每公斤體重17 μg。
需要量評估方法
- 尿液碘排泄量:
- 尿液碘排泄量是最合理實用的碘營養指標。人體飲食攝取之碘主要由尿液排出體外,故由尿碘濃度與體重及常數0.0235之乘積,可以推算出每日碘的攝取量。另外,尿碘量能反映近期數日之碘營養狀況,一般來說尿碘濃度與碘的關係如下:人體正常碘尿濃度約為100-200μg/L,當碘尿濃度小於100μg/L時,則表示缺乏危險升高,小於20μg/L則表示嚴重缺乏。
- 甲狀腺體積:
- 甲狀腺體積可以頸部觸診法診斷,依腫大程度分級,第一級為觸診可判斷但無法目測,第二級則可以目測,但精確的體積測量需用超音波法。當甲狀腺體積腫大,則表示碘的缺乏。一般成人預防甲狀腺腫之最低碘攝取量約70μg/d。
- 甲狀腺碘的新陳代謝速率:
- 甲狀腺碘的新陳代謝速率也可以用來估算碘之生理需要量。甲狀腺獲碘能力可以由口服或注射放射性碘(I131)被甲狀腺保留之比例來評估,24小時之正常值約為5–20%,但當人體缺碘時比例會增高,而碘充足時比例則減少。一般成人甲狀腺碘的獲取量約為91.2-96.5μg/d。
- 血漿促甲狀腺激素(thyroid stimulating hormone ,TSH)濃度:
- 血清促甲狀腺激素是反映個人甲狀腺機能的最佳指標,最常用在新生兒先天性甲狀腺機能低下症(congenital hypothyroidism)的篩檢。其正常濃度0.5-5mU/L,碘缺乏時濃度升高,同時對甲狀腺釋放激素(thyroid releasing hormone , TRH)的反應也增強。
建議攝取量
因碘無法長久儲存於身體中,故每天皆需攝取少量的碘。建議每天碘的攝取量如下:0~7歲約90μg;7~12歲約120μg;12歲以上約150μg,懷孕及哺乳婦女不僅需要滿足自己的機體需要,還要滿足胎兒發育所需,如缺碘易造成胎兒生長緩慢、智力異常,故所需攝取量較一般成人高約200μg。
碘的建議攝取量會受碘的吸收量而有所增減,一般而言無機態碘化合物的吸收率通常90%以上。
有些食物含有甲狀腺腫素(goitrogens),會干擾甲狀腺素合成與利用,例如:樹薯中亞麻苦甘(linamarin)代謝生成的硫氰化合物;十字花科植物,如:高麗菜。受污染河井的腐質物、含碘量高之放射顯影劑、食品添加物、藥物、皮膚或口腔除臭劑、水淨化劑等等也可能干擾碘的利用。
碘攝取過量對身體有害,每天1500μg對成人有害,故訂有碘的上限攝取量(tolerable upper intake levels,UL)。1~3歲孩童為200μg,4~6歲為300μg,7~9歲為400μg,10~12歲為600μg,13~15歲為800μg,16歲之後則均為1000μg。懷孕期和哺乳期因為對碘耐受力並不改變,故也以1000μg/d為上限攝取量。至於0~12個月嬰兒則不訂定上限攝取量,因為其碘來源應限於母乳、嬰兒配方與日用食物。
參見
- 氫碘酸
- 碘化氫
- 碘酸
参考资料
^ 1.01.1 CRC Handbook of Chemistry and Physics 97th Edition. 2016-06-24: 4–66. ISBN 1-4987-5428-7 (英语). 使用|accessdate=需要含有|url=(帮助)
^ Glinka, N. L. General Chemistry 2. Mir Publishing. 1981.
^ Phase Determination Using Halide Ions (By Miroslawa Dauter and Zbigniew Dauter) [1]
^ Gropper SS, Groff JL, et al.(2005)Advanced Nutrition and Human Metabolism, 4th ed., pp. 468-473. Wardswirth, ISBN 978-0-534-55986-1
^ iodine deficiency disorder. [2018-11-12].
^ http://www.scielosp.org/img/revistas/bwho/v83n7/a12tab04.gif
^ mailto:www-bgs@bgs.ac.uk, British Geological Survey 1998 - 2017 (c)NERC. British Geological Survey Website - Page not found. www.bgs.ac.uk. [2018-11-12].
^ 中国高碘地方性甲状腺肿的发现历程和分布概况 (PDF). [2018-11-12].
^ http://www.item.org.hk/trad/element/iodine.html
元素周期表(卤素) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| | IA 1 | IIA 2 | IIIB 3 | IVB 4 | VB 5 | VIB 6 | VIIB 7 | VIIIB 8 | VIIIB 9 | VIIIB 10 | IB 11 | IIB 12 | IIIA 13 | IVA 14 | VA 15 | VIA 16 | VIIA 17 | VIIIA 18 | ||||||||||||||||||
1 | H | | He | |||||||||||||||||||||||||||||||||
2 | Li | Be | | B | C | N | O | F | Ne | |||||||||||||||||||||||||||
3 | Na | Mg | | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||
4 | K | Ca | | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||
5 | Rb | Sr | | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||
6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||
7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||
| ||||||||||||||||||||||||||||||||||||
| ||||||
|