氯化铝
| 氯化鋁 | |
|---|---|
 | |
 | |
IUPAC名 Aluminium(III) chloride | |
| 别名 | 三氯化鋁 |
| 识别 | |
CAS号 | 7446-70-0(無水) 10124-27-3((hydrate)) 7784-13-6((hexahydrate)) |
PubChem | 24012 |
ChemSpider | 22445 |
SMILES |
|
InChI |
|
InChIKey | VSCWAEJMTAWNJL-DFZHHIFOAR |
Gmelin | 1876 |
ChEBI | 30114 |
RTECS | BD0530000 |
| 性质 | |
化学式 | AlCl3 |
摩尔质量 | (無水) 133.34 g mol−1 (含結晶水) 241.432 g·mol⁻¹ |
| 外观 | 易潮解的黃色或白色固體 |
密度 | 2.48 |
熔点 | 190 °C (463 K 2.5 大氣壓) |
沸点 | 178 °C (451 K) (昇華) |
溶解性(水) | 43.9 g/100 ml (0°C) 44.9 g/100 ml (10°C) 45.8 g/100 ml (20°C) 46.6 g/100 ml (30°C) 47.3 g/100 ml (40°C) 48.1 g/100 ml (60°C) 48.6 g/100 ml (80°C) 49 g/100 ml (100°C) |
| 结构 | |
晶体结构 | 6配位层状晶格 |
配位几何 | 八面體(固體), 四面體(液體) |
分子构型 | 平面三角形(單分子蒸氣) |
| 危险性 | |
欧盟危险性符号  腐蚀性 C 腐蚀性 C | |
警示术语 | R:R34 |
安全术语 | S:S1/2-S7/8-S28-S45 |
| 相关物质 | |
| 其他阴离子 | 氟化鋁,溴化鋁,碘化鋁 |
| 其他阳离子 | 氯化硼,氯化鎵,氯化銦,氯化鉈,氯化鎂 |
| 相关路易斯酸 | 氯化鐵,氟化硼 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
氯化鋁,或三氯化铝,化学式为AlCl3,是氯和鋁的化合物。氯化鋁熔點、沸點都很低,且會昇華,為有離子性的共價化合物。熔化的氯化鋁不易導電[1],和大多數含鹵素離子的鹽類(如氯化鈉)不同。
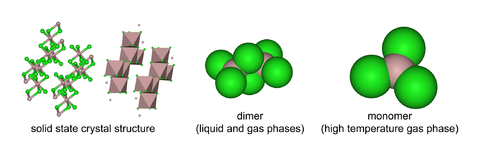
AlCl3采取“YCl3”结构,为Al3+立方最密堆积层状结构,[2] 而AlBr3中Al3+却占Br−最密堆积框架的相邻四面体间隙。熔融时AlCl3生成可挥发的二聚体Al2Cl6,含有两个三中心四电子氯桥键,更高温度下Al2Cl6二聚体则离解生成平面三角形AlCl3,与BF3结构类似。
氯化鋁是很常用的路易斯酸。在化學工業,它常是傅-克反應的催化劑。它亦用於烴的聚合和异构化反应中。
鋁亦可以生成一氯化鋁(AlCl),但這种化合物很不穩定,只能以氣態的形式出現。
工業上,它經鋁土礦加工,由鋁和氯之間的放熱反應所製。
目录
1 化學性質
2 用途
3 注意事項
4 參考文獻
化學性質
氯化鋁是強路易斯酸, 可和路易斯鹼作用產生化合物,甚至也可和二苯甲酮和均三甲苯之類的弱路易斯鹼作用。[3]
若有氯離子存在,氯化鋁會生成(四)氯鋁酸根離子AlCl4−:
- AlCl3(aq) + Cl−(aq) ⇌ AlCl4−(aq)
在水中,氯化鋁會部分水解,形成氯化氫气体或H3O+離子。其水溶液和其他含鋁物质的溶液相同,含有水合铝离子,跟適當份量的氫氧化鈉反應可生成氫氧化鋁沉淀:[4]
- AlCl3(aq) + 3 NaOH(aq) → Al(OH)3(s) + 3NaCl(aq)
- AlCl3(aq) + 3 H2O → AlO2-+ 3HCl + H3O+
用途
氯化鋁主要用在傅-克反应[3] 中,例如以苯和光气为原料制备蒽醌,应用于染整工業中。[1] 在廣義的傅-克反应中,醯氯或鹵代烷和芳香族物質的反應式如下:[3]
苯及其衍生物在发生上述反應时,主產物是對位的異構物。相比较下,烷基化反应涉及的问题较多,不如酰基化反应应用广泛。无论是哪种反应,氯化铝和其他原料和仪器都必须是中等干燥的,少量的水有助于反应进行。
由于氯化铝可与反应产物配位,因此应用在傅克反应时,它的用量必须与反应物相同,而非“催化量”。反应后的氯化铝很难回收,会产生大量的腐蚀性废料。为了达到绿色化学的要求,化学家开始使用三氟化釔或三氟化鏑来替代氯化铝,减少污染。
氯化鋁也常用來將醛基加在苯環上,如加特曼-科赫反應用一氧化碳、氯化氫、氯化鋁及氯化亞銅為催化劑[5]
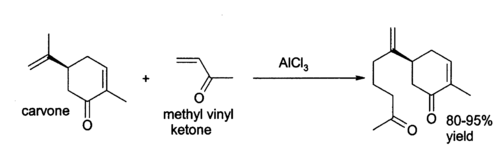
氯化铝在有机化学中有很广泛的应用。[6] 它可以催化Ene反應,比如3-丁烯-2-酮(甲基乙烯基甲酮)与香芹酮加成:[7]
AlCl3也常用在烃类聚合反应和异构化反应中,重要的例子包括[1] 工业上乙苯的生产。乙苯可用于进一步制备苯乙烯、聚苯乙烯以及用作清洁剂的十二烷基苯。
芳烃存在下,氯化铝与铝混合可用于合成二(芳烃)金属配合物。例如,二苯铬就是通过特定金属卤化物经由Fischer-Hafner合成制备的。
低浓度的碱式氯化铝常是防汗药的成分之一,而多汗症患者在使用时浓度会高些(12%或更高)。
注意事項
無水氯化鋁會和鹼劇烈反應,因此需妥善處理。含結晶水的氯化鋁較無此問題。
如果吸入無水氯化鋁或接觸眼睛和皮膚會造成刺激。
參考文獻
^ 1.01.11.2 N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, Pergamon Press, Oxford, United Kingdom, 1984.
^ A. F. Wells, Structural Inorganic Chemistry, Oxford Press, Oxford, United Kingdom, 1984.
^ 3.03.13.2 G. A. Olah (ed.), Friedel-Crafts and Related Reactions, Vol. 1, Interscience, New York, 1963.
^ 氯化铝字典-Guidechem.com
^ L. G. Wade, Organic Chemistry, 5th edition, Prentice Hall, Upper Saddle River, New Jersey, United States, 2003.
^ P. Galatsis, in: Handbook of Reagents for Organic Synthesis: Acidic and Basic Reagents, (H. J. Reich, J. H. Rigby, eds.), pp12-15, Wiley, New York, 1999.
^ B. B. Snider, Accounts of Chemical Research 13, 426 (1980).
| ||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|