热力学
| 热力学 | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 经典的卡诺热机 T(熱庫)、Q(熱量)、W(功) H(高溫)、C(低溫) | |||||||||||||||||||||
分支
| |||||||||||||||||||||
定律
| |||||||||||||||||||||
系统
| |||||||||||||||||||||
系统性质
| |||||||||||||||||||||
材料性质
| |||||||||||||||||||||
方程
| |||||||||||||||||||||
势
| |||||||||||||||||||||
历史/文化
| |||||||||||||||||||||
科学家
| |||||||||||||||||||||
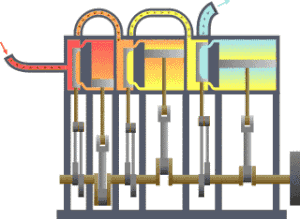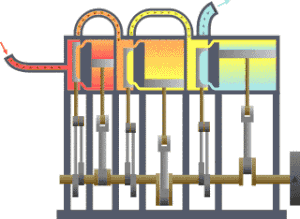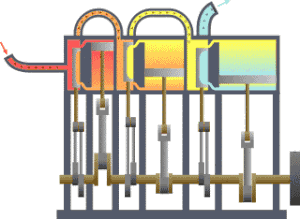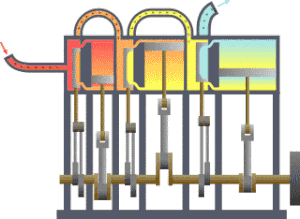
一个典型的熱力學系統,热从较热处(锅炉)流向较冷处(冷凝器),在这一过程中有一系列活塞做了功。
热力学,全稱熱動力學(法语:thermodynamique,德語:Thermodynamik,英语:thermodynamics,源於古希腊语θερμός及δύναμις)是研究热现象中物态转变和能量转换规律的学科;它着重研究物质的平衡状态以及与準平衡态的物理、化学过程。热力学定義許多巨觀的物理量(像溫度、內能、熵、壓強等),描述各物理量之間的關係。热力学描述數量非常多的微觀粒子的平均行為,其定律可以用統計力學推導而得。
熱力學可以總結為四條定律。
熱力學第零定律定義了温度這一物理量,指出了相互接觸的两个系統,熱流的方向。
熱力學第一定律指出内能這一物理量的存在,並且與系統整體運動的動能和系統与與環境相互作用的位能是不同的,區分出熱與功的轉換。
熱力學第二定律涉及的物理量是温度和熵。熵是研究不可逆过程引入的物理量,表征系統通過熱力學過程向外界最多可以做多少熱力學功。
熱力學第三定律認為,不可能透過有限過程使系統冷却到絕對零度。
熱力學可以應用在許多科學及工程的領域中,例如:引擎、相變化、化學反應、輸運現象甚至是黑洞。熱力學計算的結果不但對物理的其他領域很重要,對航空工程、航海工程、車輛工程、機械工程、細胞生物學、生物醫學工程、化學、化學工程及材料科學等科學技術領域也很重要,甚至也可以應用在經濟學中[1][2]。
热力学是从18世纪末期发展起来的理论,主要是研究功與热量之間的能量轉換;在此功定義為力與位移的內積;而熱則定義為在熱力系統邊界中,由溫度之差所造成的能量傳遞。兩者都不是存在於熱力系統內的性質,而是在熱力過程中所產生的。
熱力學的研究一開始是為了提昇蒸汽引擎的效率,早期尼古拉·卡諾有許多的貢獻,他認為若引擎效率提昇,法國有可能贏得拿破崙戰爭[3]。出生於愛爾蘭的英國科學家開爾文在1854年首次提出了熱力學明確的定義[4]:
| “ | 熱力學是一門描述熱和物體中各部份之間作用力的關係,以及描述熱和電器之間關係的學科。 | ” |
一開始熱力學研究關注在熱機中工質(如蒸氣)的熱力學性質,後來延伸到化学过程中的能量轉移,例如在1840年科學家杰迈因·亨利·盖斯提出,有關化學反應的能量轉移的研究[5]。化學熱力學中研究熵對化學反應的影響[6][7][8][9][10][11][12][6][13][14] 。
統計熱力學也稱為統計力學,利用根據微觀粒子力學性質的統計學預測來解釋巨觀的熱力學性質。
目录
1 簡介
2 热力学史
3 分支学科
3.1 经典热力学
3.2 局域平衡态热力学
3.3 扩展热力学
3.4 统计热力学
4 熱力學定律
5 系統模型
6 熱力學設備
7 共軛變數
8 局限性
9 子学科
10 注释
11 参考文献
12 参见
簡介
熱力學一詞一般是指物體和過程的巨觀描述[15]:「古典熱力學和個別原子的性質無關」[16]。「統計熱力學」會用個別原子的性質來描述物體和過程,主要是將其描述為一群有類似特性的粒子,彼此的機率都相同。
熱力學最早是在研究能量的轉移,藉由巨觀變數可以將能量轉移分為二類:熱和功[17][18]。
熱力學平衡是熱力學中幾個最重要概念中的一個[19]。一個熱力學平衡系統的溫度可以明確定義,可能也是熱力學中最有代表性的物理量。若系統及過程不在熱力學平衡的狀態,就很難進行精確的熱力學研究。不過在工程的應用中,往往會通过简单的近似计算,用平衡熱力學中的物理量,得到較實用的數值。在許多實際的系統中(例如熱機及冰箱),系統會包括數個有不同溫度和壓強的子系統,若這些子系統的熱力學變數已足夠接近明確定義的情形,就可以用較有效的方法來求解熱力學系統的變數。
热力学最基础的概念是系统和环境[20]。一个热力学系统的环境是与之相互作用的其他热力学系统。热力学环境的一个典型例子是热浴,使系统的温度维持在某特定值,具体的相互作用形式可不去关心。
热力学最基本的实体是热力学状态和热力学过程。热力学中的推理可基于热力学状态或热力学循环过程。
热力学系统可由其状态来描述,热力学系统是个宏观物理对象,由描述宏观性质的物理和化学变量描述。所需的宏观态变量视具体的实验而定。
热力学系统可由其所经历的过程来描述,尤其是循环过程,这也是热力学创立者所采用的方法。
热力学和统计热力学应用于研究某一体系的过程,过程中分子的运动可分为两类:
- 快速运动,在所研究的过程的时间尺度上,分子可以遍历它所有可能的状态,使体系很快达到热力学平衡。
- 慢速运动,在所研究的过程的时间尺度上,可忽略分子运动。[21][22]
如果宏观过程中,分子运动介于快速运动和慢速运动之间,在所研究的过程的时间尺度上,系统一般处于非平衡态。分离分子运动的时间尺度是热力学中经常考虑的问题。
例如,经典热力学主要是研究物质的状态方程,宏观力学量和温度比环境的变化要快很多,实际上是研究热力学平衡下的状态变量。状态方程表述的是系统的本构特性。状态方程常写为压强是体积和温度的函数。[23][24][25][26]
本条目以由浅入深的方式介绍热力学,先介绍循环过程和热力学平衡态,最后介绍热力学非平衡态。
热力学史

热力学始创八学派的代表性科學家
热力学史可追溯到1650年格里克设计和建造了世界上第一个真空泵,并用马德堡半球实验证明了真空的存在,推翻了亚里士多德提出的“自然界厌恶真空”的假说。1656年,物理学家和化学家罗伯特·波义耳借鉴格里克的设计,与罗伯特·胡克发明了抽气机[27]。利用抽气机,波义耳和胡克证明了压强、温度和体积之间有一定的关系,波义耳给出了波义耳定律,对于一定温度下的一定量的气体,压强与体积成反比。1679年,波义耳的助手丹尼斯·帕潘发明了蒸汽蒸煮器,这是一个严密封盖的容器,里面会产生高压气体。帕潘后来对他发明的蒸煮器做了改进,加装了放气阀门,避免爆炸。帕潘观察到了阀门的周期性的运动,构想出活塞和汽缸蒸汽机,但是他没有去实现自己的想法。1697年,工程师托马斯·萨弗里在帕潘的设计的基础上,发明了第一个蒸汽机。随后,1712年,汤玛斯·纽科门也发明了一种蒸汽机。这些早期的蒸汽机非常粗糙,效率很低,但吸引了当时顶尖的科学家的注意。
1759年,詹姆斯·瓦特开始设计蒸汽机,屡经失败。瓦特向格拉斯哥大学的教授约瑟夫·布拉克求教。布拉克向其讲解了自己提出的热容和潜热的概念,瓦特还想出了分离冷凝器的想法,终于显著提高了蒸汽机的效率[a]。尼古拉·卡诺总结前人工作,在1824年发表著作《论火的动力》。这部著作论述了卡诺热机和卡诺循环的关系。这部著作是热力学成为现代科学的标志,卡诺也被称作热力学之父。
19世纪50年代,热力学第一和第二定律同时形成,主要完成者是威廉·约翰·麦夸恩·兰金、鲁道夫·克劳修斯和威廉·汤姆森。1859年,史上第一部热力学教科书出版,作者是兰金。[28]
统计热力学的创立者包括:馬克士威、玻尔兹曼、普朗克、克劳修斯、吉布斯。
分支学科
热力学系统是理论上构建出来,以热力学定律研究有物质和能量交换的物理系统。热力学系统的研究可分为几个分支学科,各自有不同的基本模型,或采用不同的原理。
经典热力学
经典热力学用不随时间改变的平衡态或者连续的循环过程描述和研究热力学系统。应用的物理量是不随时间改变的实验可测量的宏观平衡态的物理量,即物理量的长时间平均的量不随时间改变,比如循环过程的流。
局域平衡态热力学
扩展热力学
统计热力学
熱力學定律
熱力學第零定律:在不受外界影响的情况下,只要A和B同时与C处于热平衡,即使A和B没有热接触,他们仍然处于热平衡状态。这个定律说明,互相处于热平衡的物体之间必然具有相等的温度。
熱力學第一定律:能量守恒定律对非孤立系统的扩展。此时能量可以以功W或热量Q的形式传入或传出系统。热力学第一定律表达式为:ΔEint =Eint,f−Eint,i=Q+W{displaystyle Delta E_{text{int}} =E_{text{int,f}}-E_{text{int,i}}=Q+W}
熱力學第二定律:孤立系統熵(失序)不會減少──簡言之,熱不能自發的從冷處轉到熱處,而不引起其他变化。任何高溫的物體在不受熱的情況下,都會逐漸冷卻。这条定律说明第二类永动机不可能制造成功。熱力學第二定律也可表示為熵增原理:ΔS≥0{displaystyle Delta Sgeq 0}。
熱力學第三定律:完整晶体於絕對溫度零度時(即攝氏-273.15度),熵增為零。
系統模型
| 熱力學系統分類 | 交換方式 | ||
|---|---|---|---|
質量 | 功 | 熱 | |
開放系統 | |||
封閉系統 | |||
| 絕熱封閉系統 | |||
| Adynamically封閉系統 | |||
孤立系統 | |||
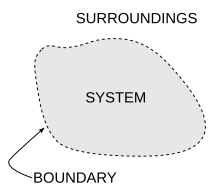
熱力學系統的示意圖
熱力學系統是熱力學的重要概念之一,是指一塊有明確定義的區域,所有不在熱力學系統內的區域合稱為環境,系統和環境之間是由邊界隔開,系統和環境透過邊界才能交換物質、功或熱。
邊界就是包圍系統外圍的表面,任何通過表面,會影響系統內能的都需要在能量平衡方程式中考慮。像马克斯·普朗克在1900年時的研究就將系統定義為單一原子周圍有共振能量的區域,薩迪·卡諾在1824年將系統定義為蒸汽机中的蒸氣,克里·伊曼紐爾在1986年有關大氣熱力學的研究中將系統定義為熱帶氣旋的本體。在量子統計力學中會將核素(一個由夸克組成的系統)定義為一個系統。
邊界可分為四種:固定、活動、真实、虛構。在引擎中的固定邊界是指活塞固定在某特定位置,因此在等容過程中,不會產生功。而在引擎中的活動邊界是指允許活塞移動位置,因此可以產生功。在封閉系統中,邊界是真实的,而在開放系統中,邊界多半是虛構的。[29]
系統可以依邊界允許的質量或能量交換方式來分類,簡單分類可以分為以下三類:
孤立系統:系統完全不與外界交換能量或質量。
封閉系統:系統只與外界交換能量而不交換質量。
開放系統:系統與外界交換能量和質量。
但若將能量再細分為功和熱,封閉系統可以再多區分出二類,其性質介於封閉系統和孤立系統之間:若系統不允許外界交換熱,只能有功的交換,稱為絕熱封閉系統或熱孤立系統,若系統不允許外界交換功,只能有能的交換,稱為Adynamically封閉系統[30],也稱作力學孤立系統。
熱力學設備

卡諾循環,其中的TH和TC就是高溫熱庫及低溫熱庫
熱力學設備可分為二種,分為是儀表(meter)和源(reservoir)。熱力學儀表是指任何可以量測熱力學系統中參數的設備。有時熱力學的參數是用理想的量測儀表來定義,例如熱力學第零定律說明若二個物體分別和一個物體達到熱平衡,這二個物體之間也達到了熱平衡達到熱平衡。馬克士威在1872年時提出熱力學第零定律,也提到可以量測溫度的方式。理想的溫度計是在定壓下定量的理想氣體,根據理想氣體定律PV=nRT,氣體的體積即可用來表示壓強,雖然壓強是用力學的方式定義,也可以用定溫下定量的理想氣體的體積來當作理想的气压表。热量计則是量測系統內能及能量變化的設備。
熱力學源是指一個很大的系統,和測試系統接觸時其特定狀態幾乎不會變化。熱力學源一般是用來將系統的狀態施加到某一特定數值。像壓強源是在特定壓強下的系統,和其他系統連接後,會使其他系統的壓強等於該特定值。地球的大氣常作為壓強源。熱力學中常見的熱力學源是熱庫,是特定溫度下的系統,像卡諾循環中就用到了高溫熱庫及低溫熱庫。[31]
共軛變數
能量是熱力學的中心概念之一。熱力學第一定律說明系統和環境的總能量守恆。若要加入能量到系統中,可以透過加熱、壓縮、加入物質的方式。若要從系統中提出能量,則可以透過冷卻、膨脹、移出物質的方式。例如在力學的能量轉移等於對一物體的施力及物體的位移。
共軛變數是成對的熱力學概念,其中第一個表示施加在熱力學系統中的某種「力」,第一個則表示熱力學系統上的某種「位移」,二者的乘積即為轉移的能量。常見的共軛變數有:
壓強-體積(力學參數)
溫度-熵(熱參數)
化學勢-粒子數(材料參數)
局限性
熱力學由於發展較早,也有其自身的局限性,主要表現在:
#它僅適用於粒子很多的宏觀系統;
#它主要研究物質在平衡態下的性質,並不解答系統達到平衡態的詳細過程;
#它把物質視作“連續體”,不考慮物質的微觀結構。
统计物理学与热力学结合起来研究热现象常常可以弥补以上局限性[32]。
子学科
- 传热学
- 计算传热学
- 材料熱力學
- 化学热力学
- 化工热力学
注释
^ The Newcomen engine was improved from 1711 until Watt's work, making the efficiency comparison subject to qualification, but the increase from the Newcomen 1765 version was on the order of 100%.
参考文献
^ Smith, J.M.; Van Ness, H.C., Abbott, M.M. Introduction to Chemical Engineering Thermodynamics. McGraw Hill. 2005. ISBN 0-07-310445-0. OCLC 56491111. 引文使用过时参数coauthors (帮助)
^ Haynie, Donald, T. Biological Thermodynamics. Cambridge University Press. 2001. ISBN 0-521-79549-4. OCLC 43993556.
^ Clausius, Rudolf. On the Motive Power of Heat, and on the Laws which can be deduced from it for the Theory of Heat. Poggendorff's Annalen der Physik, LXXIX (Dover Reprint). 1850. ISBN 0-486-59065-8.
^ Sir William Thomson, LL.D. D.C.L., F.R.S. Mathematical and Physical Papers 1. London, Cambridge: C.J. Clay, M.A. & Son, Cambridge University Press. 1882: 232.
^ Hess, H. (1840). Thermochemische Untersuchungen, Annalen der Physik und Chemie (Poggendorff, Leipzig) 126(6): 385–404.
^ 6.06.1 Enrico Fermi. Thermodynamics. Courier Dover Publications. 1956: ix. ISBN 0-486-60361-X. OCLC 230763036 54033021.
^ Gibbs, Willard, J. (1876). Transactions of the Connecticut Academy, III, pp. 108–248, Oct. 1875 – May 1876, and pp. 343–524, May 1877 – July 1878.
^ Duhem, P.M.M. (1886). Le Potential Thermodynamique et ses Applications, Hermann, Paris.
^ Lewis, Gilbert N.; Randall, Merle. Thermodynamics and the Free Energy of Chemical Substances. McGraw-Hill Book Co. Inc. 1923. 引文使用过时参数coauthors (帮助)
^ Guggenheim, E.A. (1933). Modern Thermodynamics by the Methods of J.W. Gibbs, Methuen, London.
^ Guggenheim, E.A. (1949/1967)
^ Ilya Prigogine, I. & Defay, R., translated by D.H. Everett. Chemical Thermodynamics. Longmans, Green & Co., London. Includes classical non-equilibrium thermodynamics. 1954.
^ Perrot, Pierre. A to Z of Thermodynamics. Oxford University Press. 1998. ISBN 0-19-856552-6. OCLC 123283342 38073404.
^ Clark, John, O.E. The Essential Dictionary of Science. Barnes & Noble Books. 2004. ISBN 0-7607-4616-8. OCLC 58732844 63473130.
^ Reif, F. Fundamentals of Statistical and Thermal Physics. New York: McGraw-Hill Book Company. 1965: page 122. 引文格式1维护:冗余文本 (link)
^ Fowler, R., Guggenheim, E.A. (1939). Statistical Thermodynamics, Cambridge University Press, Canbridge UK. p. 3.
^ Bridgman, P.W. (1943). The Nature of Thermodynamics, Harvard University Press, Cambridge MA, p. 48.
^ Partington, J.R. (1949). An Advanced Treatise on Physical Chemistry, volume 1, Fundamental Principles. The Properties of Gases, Longmans, Green and Co., London. page 118.
^ Tisza, L. (1966). Generalized Thermodynamics, M.I.T Press, Cambridge MA p. 18.
^ Kondepudi, D. (2008). Introduction to Modern Thermodynamics, Wiley, Chichester, ISBN 978-0-470-01598-8. Includes local equilibrium thermodynamics.
^ Fowler, R., Guggenheim, E.A. (1939), p. 13.
^ Tisza, L. (1966), pp. 79–80.
^ Planck, M. 1923/1926, page 5.
^ Partington, p. 121.
^ Adkins, pp. 19–20.
^ Haase, R. (1971), pages 11–16.
^ Partington, J.R. A Short History of Chemistry. Dover. 1989. OCLC 19353301.
^ Cengel, Yunus A.; Boles, Michael A. Thermodynamics – an Engineering Approach. McGraw-Hill. 2005. ISBN 0-07-310768-9.
^ Lauth,Günter J.; Kowalczyk, Jürgen. Thermodynamik: Eine Einführung. Springer Spektrum. 2015. ISBN 978-3-662-46228-7.
^ Partington, J.R. (1913). A Text-book of Thermodynamics, Van Nostrand, New York, page 37.
^ Windisch, Herbert. Thermodynamik: Ein Lehrbuch für Ingenieure Auflage 5. De Gruyter Oldenbourg. 2014. ISBN 978-3-486-77847-2.
^ 秦允豪. 《热学》(第二版). 高等教育出版社. : 第3页. ISBN 978-7-04-013790-3.
参见
熱力學函數(或譯:熱力學參數)- 統計力學
- 熱力學歷史
- 熱力學歷史線
| ||||||||||||||||||||||||||||||||||
|















