氯化钠
| 氯化钠 | |
|---|---|
 | |
 | |
IUPAC名 Sodium chloride | |
| 英文名 | Sodium chloride |
| 别名 | 食盐、石盐、盐、食用盐 |
| 识别 | |
CAS号 | 7647-14-5 |
PubChem | 5234 |
ChemSpider | 5044 |
SMILES |
|
InChI |
|
InChIKey | FAPWRFPIFSIZLT-REWHXWOFAE |
Beilstein | 3534976 |
Gmelin | 13673 |
EINECS | 231-598-3 |
ChEBI | 26710 |
RTECS | VZ4725000 |
KEGG | D02056 |
MeSH | Sodium+chloride |
| 性质 | |
化学式 | NaCl |
摩尔质量 | 58.44277 g·mol⁻¹ |
| 外观 | 白色或无色晶体或粉末[1] |
密度 | 2.17 g/cm³ (固)[1] |
熔点 | 802.018 °C (1075.168 K)[1] |
沸点 | 1465 °C (1738.15 K)[1] |
溶解性(水) | 36.0 g/100 g (25 °C)[1] |
溶解性 | 微溶于乙醇[1] |
折光度n D | 1.55 (500 nm)[2] |
| 结构 | |
晶体结构 | 面心立方结构[1] |
晶格常数 | a = 564 pm[3] |
配位几何 | 七面体 |
| 危险性 | |
警示术语 | R:R36 |
安全术语 | S:无 |
NFPA 704 |  0 0 0 |
LD50 | 3 g/kg(口服,大鼠)[4] |
| 相关物质 | |
| 其他阴离子 | 氟化钠、溴化钠、 碘化钠 |
| 其他阳离子 | 氯化锂、氯化钾、 氯化铷、氯化铯、 氯化镁、氯化钙、 氯化钡 |
| 相关盐 | 乙酸钠 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
(化学式:NaCl),是一种离子化合物。钠离子和氯离子的原子质量分别为22.99和35.45g/mol。也就是说100g的氯化钠中含有39.34 g的钠和 60.66 g的氯。氯化钠是海水中盐分的主要组成部分,它的存在也使得海水有其特有的咸味苦味。氯化钠也是细胞外液的主要盐类,0.9%的氯化鈉水溶液俗称为生理盐水。其可食用的形态是食盐的主要成分,多用于食物的调味和保存。
在工業中,主要用于制造氢氧化钠和氯以及应用于聚氯乙烯、塑料、木浆(紙漿)等許多其他產品的生产过程。由于它可以降低水的冰点,偶尔也用于解冻冰冻的路面。
目录
1 生产
1.1 各种化合物的生产
1.1.1 氯碱法
1.1.2 氨碱法
1.1.3 硬水软化
2 晶体结构
3 性质
3.1 物理性质
3.2 化学性质
4 制法
5 用途
5.1 餐饮
5.2 医学
5.3 工业
5.4 道路
6 参见
7 注释
8 参考资料
生产
各种化合物的生产
氯化钠是各种化学反应的生产中不可缺少的原料,不管是直接还是间接使用大都少不了。
氯碱法
由电解饱和食盐水溶液制取氫氧化鈉、氯气和氢气的工业生产方法,是重要的基础化学工业之一。其反应如下:
2 NaCl + 2 H2O → Cl2 + H2 + 2 NaOH
氨碱法
也叫索尔维法,是工业生产碳酸钠的主要方法。此反应需要氯化钠和石灰石,其产物是氯化钙和碳酸钠。
硬水软化
硬水(如井水)含有大量的镁离子鈣离子。硬水有许多危害,包括降低洗衣液的效果和阻塞水管。氯化钠用于更新软化硬水的離子交換樹脂,使其能重复使用。
晶体结构

纯净的石盐是氯化钠晶体。
氯化钠晶体的内部结构,是人类测试的第一个晶体结构[5]。氯化鈉的晶体形成立体对称,每个离子有六个相邻的离子,组成一个八面体。其晶体结构中,较大的氯离子排成立方最密堆积(ccp),较小的钠离子则填充氯离子之间的八面体的空隙。每个离子周围都被六个其他的离子包围着。这种结构也存在于其他很多化合物中,称为氯化钠型结构。
| 名称 | 英文名 | 代号 | 晶格结构 | 晶系 | 配位 | 举例 | 示意图(点击可放大) |
|---|---|---|---|---|---|---|---|
| 氯化钠结构 | NaCl structure | B1型 | 面心立方晶格 | 立方晶系 | [a] | [b] | 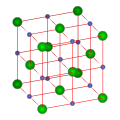 |
氯化钠的晶体主要有带正电荷的Na+和带负电荷的Cl−组成,Na+和Cl−在相互垂直的3个方向上的平面上以1:1的比例均匀分布,每个方向上的平面上电荷的代数和为0,称为“电性中和面”。“电性中和面”内静电力较强,但相互平行的相邻的“电性中和面”之间的静电力较弱,导致氯化钠晶体的解理沿着这3个互相垂直的方向产生。因此,当氯化钠晶体受到外力发生破裂时,容易沿着这3个方向破裂开形成一个垂直的“三面凹角”。
性质

常压下水盐体系的相图
物理性质
氯化钠在多数情況下是白色的粉末,其結晶是半透明的立方體,但也可能會因雜質而呈現出藍或紫的色調。氯化钠的摩尔质量是58.443克/摩尔,熔點為801 °C(1,474 °F),沸點為1,465 °C(2,669 °F),密度是每立方厘米2.17克。莫氏硬度为2~2.5。[6][7]
氯化钠易溶於水,常温下在水中的溶解度是359克/升。食盐水的物理性质与纯水有较大的差异。常压下,水盐体系的低共熔点为−21.12 °C(−6.02 °F),低共熔物中盐的质量分数为23.31%[c]。该质量分数的食盐水沸点约为108.7 °C (227.7 °F)[8]。氯化钠溶液的PH值不是正好等于7,而是视浓度,介于5.6至8.4之间[9]。
依據sigma Aldrich 物質資料表: 氯化鈉水中溶解度為(25°C) 357 mg/ml, 100°C為 384 mg/ml。飽和食鹽水之密度為 (25°C) 1.202 g/ml。
依此換算25°C 飽和食鹽水每一立方公分含316.223毫克之氯化鈉。
(網路上之飽和生理食鹽水密度錯誤甚多,推估為教學現場密度考題衍生之錯誤)
| 氯化钠在不同溶液中的溶解度 g / 1 kg ,25℃[10] | |
|---|---|
| 水 | 360 |
| 甲酰胺 | 94 |
| 甘油 | 83 |
| 1,2-丙二醇 | 71 |
| 甲酸 | 52 |
| 液氨 | 30.2 |
| 甲醇 | 14 |
| 乙醇 | 0.65 |
| 二甲基甲酰胺 | 0.4 |
| 1-丙醇 | 0.124 |
| 环丁砜 | 0.05 |
| 1-丁醇 | 0.05 |
| 异丙醇 | 0.03 |
| 1-戊醇 | 0.018 |
| 乙腈 | 0.003 |
| 丙酮 | 0.00042 |
温度 | °C | 800 | 850 | 900 | 1000 | 1100 |
电导率 σ | S·m−1 | 3,58 | 3,75 | 3,90 | 4,17 | 4,39 |
化学性质

氯化钠溶液中的NaCl(H2O)2,红色O,白色H,绿色Cl,紫色Na[12]
氯化钠是一種离子化合物,化学式為NaCl{displaystyle {ce {NaCl}}}
氯化钠溶於水時,完全电离为钠離子與氯離子[14]。他们会使纯水靠氢键键合形成的正常结构(四面体排列)遭到破坏[15]。Na+与水分子的结合力大约是水分子间氢键的4倍[d]。[16]
从冷溶液中析出的盐當中,每個鹽分子带有两个结晶水:NaCl·2H2O。
氯化钠溶液的检验可分两步完成。首先,向溶液中滴入硝酸酸化过的硝酸银溶液,有白色沉淀(氯化银)产生,证明有Cl-。然后用铂丝蘸取少量溶液,置于酒精灯上灼烧,火焰呈黄色,可证含有Na+。[17]
| 制取金属钠 | 2NaCl(熔融)=电解=2Na+Cl2↑ |
| 电解饱和食盐水 | 2NaCl + 2H2O =电解= H2↑ + Cl2↑ + 2NaOH |
| 和硝酸银反应 | NaCl + AgNO3=NaNO3 + AgCl↓ |
| 氯化钠固体中加入浓硫酸 | 2NaCl+H2SO4(浓)=加热=2HCl↑+Na2SO4 NaCl+H2SO4(浓)=微热=HCl↑+NaHSO4 |
制法
@media all and (max-width:720px){.mw-parser-output .tmulti>.thumbinner{width:100%!important;max-width:none!important}.mw-parser-output .tmulti .tsingle{float:none!important;max-width:none!important;width:100%!important;text-align:center}}

玻利維亞烏尤尼鹽沼內的天然鹽坨

印度泰米尔纳德邦的一块盐田
海水和盐湖是氯化鈉的主要来源。
- 蒸发咸水(如晾晒海水),在水没有完全蒸干前滤出氯化钠晶体。适合大量生产。[18]
- 少量精制:将粗盐溶解于水中,过滤掉不溶性杂质,再加精制剂如NaOH、Na2CO3 和CaCl2 等,使SO42−、Ca2+、Mg2+ 等可溶性杂质转化成沉淀,并滤除。最后用盐酸将pH调节至7以下,蒸干溶液,得到氯化钠晶体。
- 实验室里的制备方法:将过量的盐酸和氢氧化钠溶液混合,蒸干溶液,析出氯化钠晶体。
用途
氯化钠的用途很广,使用量也大。根据1974年的统计数据,美国生产的氯化钠中只有2.7%作为家用食盐出售,16.6%用于路面除冰[19],4.2%用于动物饲料,1.8%用于硬水软化,剩余60%以上均被用于工业生产[20]。

食盐是一种咸味调料。
餐饮
氯化钠能产生人类能感知的鹹味,是一种常见的调味料。食鹽中一般含有97至99%的氯化钠[21][22]。此外,海盐及新鮮開採的石鹽(多數來自史前海洋)也含有微量的稀有元素,這些稀有元素通常對健康有益。
食鹽中的鈉是人體必需的營養素之一,但攝取過量的食鹽易得高血壓[23],或其它心血管疾病[24]。世界衛生組織建議,成年人每天應攝取少於2克的鈉,相當於5公克食鹽[25]。
医学
氯化鈉对于地球上的生命非常重要。大部分生物组织中含有多种盐类。钠离子在体内负责调节神经冲动的传导。血液中的钠离子浓度直接关系到体液的安全水平的调节,浓度失常会导致高钠血症或低血钠症。[26]
0.9%的氯化鈉水溶液称为生理盐水,因为它与血浆有相同的渗透压。生理盐水是主要的体液替代物,广泛用于治疗及预防脱水[e],也用于静脉注射治疗及预防血量减少性休克。
工业
氯化钠是无机重化工业的基础,在无机化工中,使用的食盐比其他任何原料都要多[27]。其中,消耗食盐最多的工艺是氯碱法,该工艺通过电解食盐水制备氢氧化钠、氯气和氢气,通过电解熔盐获得金属钠和氯气。氯气主要被用于合成含氯有机化合物(如氯氟烃、聚氯乙烯)和消毒漂白,氢氧化钠则被广泛运用于无机化工和纸浆处理。另一种消耗食盐量比较大的工艺是氨碱法,该法通过往食盐水中注入氨和二氧化碳来制备碳酸氢钠,进而制备碳酸钠。大部分碳酸钠被用于制造玻璃。[28]
氯碱工业中,电解氯化钠水溶液,产生氢气、氯气和氢氧化钠。- 电解熔融氯化钠制备金属钠。可加入助熔剂(如氯化钙)降低熔点。
氨碱法、联合制碱法中,氯化钠和二氧化碳、氨气一起制备纯碱。
道路
用于路面除冰是除了工业生产之外盐的主要用途。
参见
- 食盐
- 离子晶体
注释
^ Na+和Cl−离子周围都由6个异号离子按八面体方式配位。
^ 数以百计的二元化合物,如卤化物、氧化物、硫化物、硒化物、氮化物和碳化物中,许多都是B1型的。
^ 低共熔点是盐水能够达到的最低温度。质量分数大于23.31%的盐水在冷却到该温度之前会析出盐(或其水合物),质量分数小于23.31%的盐水在冷却到该温度之前则会析出冰。
^ 但这种作用低于共价键的强度。
^ 人类与其他灵长类不同,人类通过出汗分泌大量的氯化鈉。
参考资料
^ 1.01.11.21.31.41.51.6 CRC Handbook of Chemistry and Physics 97th Edition. 2016-06-24: 4–85. ISBN 1-4987-5428-7 (英语). 使用|accessdate=需要含有|url=(帮助)
^ RefractiveIndex.INFO: Refractive index of NaCl (Sodium chloride)
^ W.T.Barrett, W.E.Wallace: Studies of NaCl-KCI Solid Solutions. I. Heats of Formation, Lattice Spacings,
Densities, Schottky Defects and Mutual Solubilities. In: Journal of the American Chemical Society 76(2), 1954, S. 366–369, doi:10.1021/ja01631a014
^ Sodium chloride. nlm.nih.gov.
^ 氯化钠的晶体结构. 中国数字科技馆. [2017-10-23].
^ Sirdeshmukh, Dinker B.; Sirdeshmukh, Lalitha & Subhadra, K. G. Alkali halides: a handbook of physical properties. Springer. 2001: 65, 68. ISBN 3-540-42180-7.
^ 氯化钠(NaCl)晶体. 吉林光正晶体有限公司. [2017-10-23].
^ Elvers, B. et al. (ed.) (1991) Ullmann's Encyclopedia of Industrial Chemistry, 5th ed. Vol. A24, Wiley, p. 319, ISBN 978-3-527-20124-2.
^ L Shu, IJ Obagbemi, S Liyanaarachchi, D Navaratna, R Parthasarathy, V Jegatheesan (2016) Why does pH increase with CaCl2 as draw solution during forward osmosis filtration,Process Safety and Environmental Protection 104, 465–471
^ Burgess, J. Metal Ions in Solution. New York: Ellis Horwood. 1978. ISBN 0-85312-027-7.
^ G. Westphal, G. Kristen, W. Wegener, P. Ambatiello, H. Geyer, B. Epron, C. Bonal, G. Steinhauser, F. Götzfried: Sodium Chloride, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2012; doi:10.1002/14356007.a24_317.pub4.
^ Klewe, B.; Pedersen, B. The crystal structure of sodium chloride dihydrate. Acta Cryst. 1974, B30: 2363–2371. doi:10.1107/S0567740874007138.
^ 王昆林. 材料工程基础. 清华大学出版社. : 44. ISBN 7302070644.
^ Wood, Frank Osborne. Salt (NaCl). Encyclopædia Britannica online. [2013-10-09]. (原始内容存档于2015-05-02).
^ Lincoln, S. F.; Richens, D. T. and Sykes, A. G. (2003) "Metal Aqua Ions" Comprehensive Coordination Chemistry II Volume 1, pp. 515–555. doi:10.1016/B0-08-043748-6/01055-0
^ 段振华. 高等学校研究生教材·高级食品化学. 中国轻工业出版社. 2012. ISBN 7501983844.
^ 氯化钠. 江西华亨生物科技有限公司. [2017-10-23].
^ Salt, U.S. Geological Survey
^ Rastogi, Nina (16 February 2010) Does road salt harm the environment? slate.com.
^ Westphal, Gisbert et al. (2002) "Sodium Chloride" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim doi:10.1002/14356007.a24_317.pub4.
^ Tesco Table Salt 750g. Tesco. [2010-12-05]. (原始内容存档于2009-05-11).Nutritional analysis provided with Tesco Table Salt states 38.9 percent sodium by weight which equals 97.3 percent sodium chloride
^ The international Codex Alimentarius Standard for Food Grade Salt (PDF). [2011-07-07]. (原始内容存档 (PDF)于2012-03-14).The content of NaCl shall not be less than 97% on a dry matter basis, exclusive of additives.
^ 科学生活:防控高血压为什么要“少吃盐”?. 中央政府门户网站. 科技日报. 2009-10-12 [2017-10-23].
^ McCarron, David A. Dietary sodium and cardiovascular and renal disease risk factors: dark horse or phantom entry?. Nephrol Dial Transplant. 2008, 23 (7): 2133–7. PMC 2441768. PMID 18587159. doi:10.1093/ndt/gfn312.
^ WHO issues new guidance on dietary salt and potassium. 世界卫生组织. 2013-01-31. (原始内容存档于2016-07-20) (英语).
^ Osanai T, Fujiwara N, Saitoh M, 等. Relationship between salt intake, nitric oxide and asymmetric dimethylarginine and its relevance to patients with end-stage renal disease. Blood Purif. 2002, 20 (5): 466–8. PMID 12207094. doi:10.1159/000063555.
^ Dennis S. Kostick Salt, U.S. Geological Survey, 2008 Minerals Yearbook
^ N.N.Greenwood、A.Earnshaw著,曹庭礼等人译. 元素化学. 高等教育出版社. 1997: 上册108-112、144,中册603-604.
| ||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|