磷酸
| 磷酸 | |
|---|---|
 | |
 | |
 | |
IUPAC名 trihydroxidooxidophosphorus phosphoric acid | |
| 别名 | 正磷酸、原磷酸 |
| 识别 | |
CAS号 | 7664-38-2 16271-20-8(半水化合物) |
PubChem | 1004 |
ChemSpider | 979 |
SMILES |
|
InChI |
|
InChIKey | NBIIXXVUZAFLBC-UHFFFAOYAI |
UN编号 | 1805 |
EINECS | 231-633-2 |
ChEBI | 26078 |
RTECS | TB6300000 |
KEGG | D05467 |
| 性质 | |
化学式 | H3PO4 |
摩尔质量 | 97.995 g/mol g·mol⁻¹ |
| 外观 | 白色固體或黏稠液體(>42 °C) |
密度 | 1.885 g/mL (液態) 1.685 g/mL (85%水溶液) 2.030 g/mL (25°C晶體) |
熔点 | 42.35 °C (無水化合物) 29.32 °C (半水化合物) |
沸点 | 158 °C (decomposition) |
溶解性(水) | 5.48 g/mL |
pKa | 2.148, 7.198, 12.319 |
黏度 | 2.4–9.4 cP (85% aq. soln.) 147 cP (100%) |
| 热力学 | |
ΔfHm | -1288 kJ·mol−1[1] |
S | 158 J·mol−1·K−1[1] |
| 危险性 | |
欧盟危险性符号  腐蚀性 C 腐蚀性 C | |
警示术语 | R:R34 |
安全术语 | S:S1/2 S26 S45 |
MSDS | ICSC 1008 |
| 欧盟编号 | 015-011-00-6 |
NFPA 704 |  0 3 0 |
闪点 | 不可燃 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
磷酸(英语:phosphoric acid)或稱為正磷酸(orthophosphoric acid),化學式H3PO4,是一种常见的无机酸,不易挥发,不易分解,几乎没有氧化性。具有酸的通性,是三元中强酸,其酸性比盐酸、硫酸、硝酸弱,但比醋酸、硼酸等强。由五氧化二磷溶于热水中即可得到。正磷酸工业上用硫酸处理磷灰石即得。用硝酸使磷氧化,可以得到较纯的磷酸;一般是83%-98%的稠厚溶液,如果再浓缩,可以得到无色晶体。磷酸在空气中容易潮解;加热会逐渐失水得到焦磷酸,进一步失水得到偏磷酸。磷酸容易自行結合成多種化合物如焦磷酸(pyrophosphoric acid)或三聚磷酸(triphosphoric acid)等。
除了用作化学试剂之外,磷酸也可主要用于制药、鐵銹轉化劑、食品添加物、溶劑、電解液、肥料、冶金、飼料等,也有在醫學美容及牙科的用途。
磷酸為三元酸,可解離出三個氫離子,因此可形成三種不同的酸根,分別是:磷酸二氫根H2PO−
4、磷酸氫根HPO2−
4以及磷酸根PO3−
4。
目录
1 結構
2 化學性質
2.1 水溶液
3 製備
3.1 加熱法
3.2 潮溼製造法
4 用途
4.1 性質
4.2 與鹵化物的反應
4.3 鐵銹轉化劑
4.4 食品添加劑
4.5 藥用
4.6 其他應用
5 生物学影響
5.1 飲料添加物
6 參考文獻
7 外部連結
8 參見
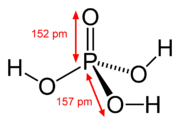
結構
以磷為中心、四個氧環繞其周圍,其中包括一个双键氧和三个羟基。三個可解離的氫原子分別與三個氧原子結合。
化學性質
純磷酸的無水化合物在室溫下為白色晶體,熔點42.35 °C,溶化後為黏稠液體。
正磷酸具有極大的極性,因此磷酸極易溶於水。
正磷酸的中心磷(P)的氧化數為+5,而周圍氧原子(O)的氧化數為-2,氫離子為+1。
磷酸为無毒性的無機物,是一種三元弱酸。三元酸的意思是可在水中解離出三顆H+的酸性物質,磷酸的解離過程如下:Ka1、Ka2和Ka3為化學式在25°C下的解離常數
- H3PO4(s) + H2O(l) ⇌H3O+(aq) + H2PO4−(aq) Ka1= 7.11×10−3
- H2PO4−(aq)+ H2O(l) ⇌H3O+(aq) + HPO42−(aq) Ka2= 6.32×10−8
- HPO42−(aq)+ H2O(l) ⇌ H3O+(aq) + PO43−(aq) Ka3= 4.49×10−13
由於磷酸的多元酸性質,使它的pH值幅度較大,造成它的緩衝現象。又由於其無毒性又容易取得,實驗室及工業常拿無毒磷酸鹽與弱酸(如檸檬酸)混合物作為緩衝溶液,
磷酸時廣泛存在於生物體中,特別是磷酸化醣類,如DNA、RNA以及ATP。
如果將正磷酸加熱,數個磷酸分子的單體會脫水聚合起來,如:
兩個磷酸相連脫去一個水,形成焦磷酸(pyrophosphoric acid,H4P2O7)
如果數個磷酸環狀相接起來,並脫去一分子水,會形成偏磷酸(metaphosphoric acid),通式為:(HPO3)n。中文命名為n偏磷酸(n≥3)。[2]偏磷酸是一種具脫水性的物質,因此常被用作乾燥劑。要進一步將偏磷酸脫水相當困難,需使用極強的脫水劑搭配加熱(單純加熱無效),才可將偏磷酸脫水形成磷酸酐(五氧化二磷,phosphorus pentoxide,化學式:P2O5,分子式:P4O10),磷酸酐具有極強的脫水性,可用作酸性物質的乾燥劑。
若在超強酸(superacids,比H2SO4還強的酸)中作用,磷酸會形成理論上具腐蝕性的酸性物質,四羟基磷酸根離子(tetrahydroxylphosphonium ion)。以氟銻酸(fluoroantimonic acid,HSbF6)作超強酸為例:
- H3PO4 + HSbF6 → [P(OH)4+][SbF6]−
水溶液
磷酸濃度的計算方法([A]為莫耳濃度)[A] = [H3PO4] + [H2PO4−] + [HPO42−] + [PO43−]
下表是磷酸在不同濃度下的pH、及磷酸的各共軛鹼濃度。
[A] (mol/L) | pH | [H3PO4]/[A] (%) | [H2PO4−]/[A] (%) | [HPO42−]/[A] (%) | [PO43−]/[A] (%) |
|---|---|---|---|---|---|
| 1 | 1.08 | 91.7 | 8.29 | 6.20×10−6 | 1.60×10−17 |
| 10−1 | 1.62 | 76.1 | 23.9 | 6.20×10−5 | 5.55×10−16 |
| 10−2 | 2.25 | 43.1 | 56.9 | 6.20×10−4 | 2.33×10−14 |
| 10−3 | 3.05 | 10.6 | 89.3 | 6.20×10−3 | 1.48×10−12 |
| 10−4 | 4.01 | 1.30 | 98.6 | 6.19×10−2 | 1.34×10−10 |
| 10−5 | 5.00 | 0.133 | 99.3 | 0.612 | 1.30×10−8 |
| 10−6 | 5.97 | 1.34×10−2 | 94.5 | 5.50 | 1.11×10−6 |
| 10−7 | 6.74 | 1.80×10−3 | 74.5 | 25.5 | 3.02×10−5 |
| 10−10 | 7.00 | 8.24×10−4 | 61.7 | 38.3 | 8.18×10−5 |
製備
磷酸有三種製備方法,加熱法(thermal process)、潮溼製造法(wet process)及乾窯法(dry kiln process)
加熱法
燃燒磷单质產生五氧化二磷並且溶於水產生磷酸。此方法可生產較純的磷酸,因為在煉製磷的過程中已經去除許多雜質,然而仍需去除藏在裡面的砷。
純磷的現代製法大部分是將磷酸鈣與砂(主要成分為二氧化矽)及焦炭一起放在電爐中加熱。化學式如下:
- Ca3(PO4)2+3SiO2→3CaSiO3+P2O5
- P2O5+5C→2P+5CO
潮溼製造法
潮溼製造法是在磷酸鈣中加入硫酸,磷酸鈣的來源通常是磷灰石。
反應:(X為鹵素)
- Ca5(PO4)3X + 5 H2SO4 + 10 H2O → 3 H3PO4 + 5 CaSO4·2H2O + HX
硫酸鈣溶解度較小,因此可以被過濾掉。
以此方法最初製造出來的磷酸濃度大約含有23%至33%的P2O5,再進行蒸餾或稀釋調整成想要的濃度。商品級的磷酸約54%,而超磷酸的濃度約70%.[3][4]
潮溼製造法的產品還須經過純化移除掉內含的氟化物及砷化物。
用途
性質
濃磷酸約75–85%左右,為澄清、無色、無味、非揮發性的濃稠液體。磷酸雖然無毒性,但85%的濃磷酸具有腐蝕性。
在如此高的濃度下,濃磷酸中的磷酸分子會聚合起來聚磷酸,
與鹵化物的反應
磷酸與鹵化物會產生氫鹵化物氣體,在實驗室可以此法製備氫鹵酸。
NaCl(s)
+ H3PO4(l) → NaH2PO4(s)
+ HCl(g)
NaBr(s)
+ H3PO4(l) → NaH2PO4(s)
+ HBr(g)
NaI(s)
+ H3PO4(l) → NaH2PO4(s)
+ HI(g)
鐵銹轉化劑
磷酸可作為鐵銹轉化劑的成分,磷酸可將紅棕色的Fe2O3轉為黑色的FePO4,予以剝除後可露出新的金屬面,也可暫不進行剝除,讓他作為金屬面的保護層,防止其進一步的氧化。
鐵銹轉化劑有時被配置成液體供金屬浸泡。有時被配置成凝膠狀,暱稱「海軍果醬(naval jelly)」,可塗抹在垂直或陡峭的斜面上。
食品添加劑
食品級的磷酸可用來酸化飲品或食物,如可樂等。[5]
藥用
磷酸也被應用於牙科及美容上。牙科方面,磷酸可用於清潔牙面及牙齒美白。
磷酸也被添加於防暈藥。
其他應用
除了以上的應用外,磷酸還有下列用途:
- 含有磷-31的磷酸可作為核磁共振的外標物
- 高性能液相色譜法
- 溫氏法(Wentworth Process):作為活性碳的氧化劑。[6]
磷酸燃料電池中的電解液。- 作為烯烃和水加成的催化劑以製造醇類。
- 作為銅電鍍拋光的電解液。
- 作為助焊劑
- 在半導體製程當中,磷酸可做為蝕刻的溶劑,例如:磷酸與過氧化氫的混合物可將InGaAs轉為InP,達到蝕刻的目的[7]。
- 蝕刻氮化矽,磷酸可將Si3N4轉化為SiO2。[8]
- 做為緩衝溶液。
- 作為皮革處理及洗滌劑的分散媒。
- 作為保養品中pH值的調節劑[9]。
- 建築業上用磷酸以移除礦物沉積物、水泥圖片及水漬。
- 家庭清潔劑。
水耕法中用作pH值的調節劑,也可作為植物磷養分的直接來源。
水族箱中,使用磷酸作為消除綠斑藻的工具,以及有利於水草生長
生物学影響
飲料添加物
磷酸用在食品添加劑,素來有骨質疏鬆症的疑慮。以往的調查是藉由問卷選填飲用可樂及其他碳酸飲料的頻率,發現飲用碳酸飲料的受試者較易有骨質疏鬆症的問題。研究指出,飲用碳酸飲料者沒有比其他人攝取更多的磷,但身體的鈣磷比卻顯著的降低。《美國臨床營養學雜誌》(American Journal of Clinical Nutrition)中的有項研究[10]在1996年至2001年使用雙倍能量的X光去探測1672位女性及1148位男性的骨密度,發現磷酸確實會降低骨密度,此研究提供了比以往使用問卷調查更有利的證據。
另一項臨床研究指出,磷的攝取會降低骨密度。但此實驗以磷的總攝取量為主,並未明確證明使骨密度降低的主因是磷酸。[11]
但在Heaney及Rafferty使用鈣平衡的方法對於20至40歲的女人一日習慣飲用三杯以上(680 mL)碳酸飲料進行的臨床研究,卻發現含磷酸的碳酸飲料與钙流失無關。[12]研究比較了水、牛奶以及各種非酒精飲料(兩種含咖啡因,兩種不含咖啡因,兩種含磷酸,兩種含檸檬酸)。他們發現,相較於水,只有牛奶以及另外兩項含有咖啡因的飲品會增加尿液中的鈣含量,而添加有磷酸的咖啡因飲料和含咖啡因的飲料鈣量流失速度差不多,並沒有擴大咖啡因造成流失鈣質的影響。由於研究顯示咖啡因所造成的鈣質流失會逐漸補回來[13],而磷酸在實驗中又沒有對鈣質流失造成影響。Heaney及Rafferty認為前面實驗受試者骨質疏鬆的原因是受試者飲用碳酸飲料,造成牛奶攝取量的漸少,造成鈣攝取量不足。
咖啡因被認為也是被認為造成骨質疏鬆的元凶之一。[12][來源請求]。
參考文獻
^ 1.01.1 Zumdahl, Steven S. Chemical Principles 6th Ed.. Houghton Mifflin Company. 2009: A22. ISBN 0-618-94690-X.
^ acid The Columbia Encyclopedia, Sixth Edition.
^ Thomas, W P and Lawton, W S "Stable ammonium polyphosphate liquid fertilizer from merchant grade phosphoric acid" 美國專利 4,721,519, Issue date: January 26, 1988
^ Super Phosphoric Acid 0-68-0 Material Safety Data Sheet (PDF). J.R. Simplot Company. May 2009 [4 May 2010]. (原始内容 (PDF)存档于2011年7月16日).
^ Current EU approved additives and their E Numbers. Foods Standards Agency. 14 March 2012 [22 July 2012].
^ Toles, C.; Rimmer, S.; Hower, J.C. Production of activated carbons from a washington lignite using phosphoric acid activation. Carbon (Elsevier BV). 1996, 34 (11): 1419–1426. ISSN 0008-6223. doi:10.1016/s0008-6223(96)00093-0.
^ Wet chemical etching. umd.edu
^ Wolf, S.; R.N. Tauber. Silicon processing for the VLSI era: Volume 1 – Process technology. 1986: 534. ISBN 0-9616721-6-1. 引文使用过时参数coauthors (帮助)
^ Ingredient dictionary: P. Cosmetic ingredient dictionary. Paula's Choice. [16 November 2007]. (原始内容存档于2008年1月18日).
^ Tucker, K. L.; Morita, K.; Qiao, N.; Hannan, M. T.; Cupples, L. A.; Kiel, D. P. Colas, but not other carbonated beverages, are associated with low bone mineral density in older women: The Framingham Osteoporosis Study. The American journal of clinical nutrition. 2006, 84 (4): 936–942. PMID 17023723.
^ Elmståhl, S.; Gullberg, B.; Janzon, L.; Johnell, O.; Elmståhl, B. Increased incidence of fractures in middle-aged and elderly men with low intakes of phosphorus and zinc. Osteoporosis international : a journal established as result of cooperation between the European Foundation for Osteoporosis and the National Osteoporosis Foundation of the USA. 1998, 8 (4): 333–340. PMID 10024903. doi:10.1007/s001980050072.
^ 12.012.1 Heaney, R. P.; Rafferty, K. Carbonated beverages and urinary calcium excretion. The American journal of clinical nutrition. 2001, 74 (3): 343–347. PMID 11522558.
^ Barger-Lux, M. J.; Heaney, R. P.; Stegman, M. R. Effects of moderate caffeine intake on the calcium economy of premenopausal women. The American journal of clinical nutrition. 1990, 52 (4): 722–725. PMID 2403065.
外部連結
维基共享资源中相关的多媒体资源:磷酸 |
- International chemical safety card 1008
- National pollutant inventory – Phosphoric acid fact sheet
- NIOSH Pocket guide to chemical hazards
- Excel spreadsheet containing phosphoric acid titration curve, distribution diagram and buffer pH calculation
參見
- 磷酸盐
- 磷酸銨
- 磷脂
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||
|