電子層
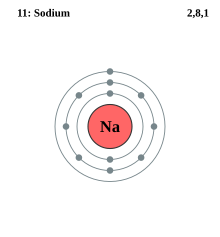
钠原子电子层模型
電子層,或稱電子殼或電子殼層,是原子物理學中,一組擁有相同主量子數n的原子軌道。電子層組成為一粒原子的電子序。這可以證明電子層可容納最多電子的數量為2n2{displaystyle 2n^{2}}
亨利·莫塞萊和查尔斯·巴克拉的X-射線吸收研究首次於實驗中發現電子層。巴克拉把它們稱為K、L和、M(以英文字母排列)等電子層。這些字母後來被n值1、2、3等取代。它們被用於分光鏡的西格班記號法。
電子層的名字起源於波耳模型中,電子被認為一組一組地圍繞著核心以特定的距離旋轉,所以軌跡就形成了一個殼。
目录
1 历史
2 主电子层
3 亚层
4 每一层的电子数
5 参考资料
历史
主电子层
电子层从内向外分别是:K,L,M,N,O,P以及Q,或记作1,2,3,4,5,6以及7。
亚层
每个电子层由至少一个的亚层组成,且每一个都占据了一个原子轨道。比如,最里面的主电子层(K)有一个亚层1s;L层有两个亚层,2s和2p;M层有3s,3p和3d;N层有4s,4p,4d和4f;O层有5s,5p,5d,5f亚层,理论上可以有更多亚层,但锕系元素的电子层都只占有5f亚层的一部分。
| 亚层符号 | ℓ | 极限电子数 | 主层 | 命名來源 |
|---|---|---|---|---|
| s | 0 | 2 | 每个主层 | sharp |
| p | 1 | 6 | 第二层及以上 | principal |
| d | 2 | 10 | 第三层及以上 | diffuse |
| f | 3 | 14 | 第四层及以上 | fundamental |
| g | 4 | 18 | 第五层及以上 | f 的后一个字母 |
每一层的电子数
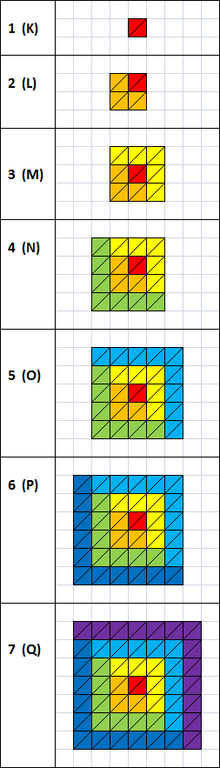
电子层和亚电子层。1个直角三角形相当于一个电子。红色代表s亚层;橙色p;黄色d;绿色f;蓝色g;青蓝色h;紫色i
| Shell name | Subshell name | Subshell max electrons | Shell max electrons |
|---|---|---|---|
| K | 1s | 2 | 2 |
| L | 2s | 2 | 2 + 6 = 8 |
2p | 6 | ||
| M | 3s | 2 | 2 + 6 + 10 = 18 |
3p | 6 | ||
3d | 10 | ||
| N | 4s | 2 | 2 + 6 + 10 + 14 = 32 |
4p | 6 | ||
4d | 10 | ||
4f | 14 | ||
| O | 5s | 2 | 2 + 6 + 10 + 14 + 18 = 50 |
5p | 6 | ||
5d | 10 | ||
5f | 14 | ||
5g | 18 |
每个亚层最多可以容纳4ℓ + 2个电子,即:
- 每个s亚层最多有2个电子
- 每个p亚层最多有6个电子
- 每个d亚层最多有10个电子
- 每个f亚层最多有14个电子
- 每个g亚层最多有18个电子
参考资料
- Tipler, Paul & Ralph Llewellyn (2003). Modern Physics (4th ed.). New York: W. H. Freeman and Company. ISBN 0-7167-4345-0