锡
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外觀 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
银白色金属  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概況 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名稱·符號·序數 | 锡(tin)·Sn·50 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素類別 | 貧金屬 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
族·週期·區 | 14 ·5·p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 標準原子質量 | 118.710 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子排布 | [氪] 4d10 5s2 5p2 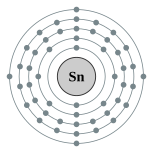 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 歷史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物態 | 固态 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) (白锡) 7.365 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) (灰锡) 5.769 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
熔點時液體密度 | 6.99 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔點 | 505.08 K,231.93 °C,449.47 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸點 | 2875 K,2602 °C,4716 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化熱 | (白锡) 7.03 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化熱 | (白锡) 296.1 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比熱容 | (白锡) 27.112 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸氣壓
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性質 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化態 | 4, 3[1], 2, 1[2], -4 (两性) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電負性 | 1.96(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電離能 | 第一:708.6 kJ·mol−1 第三:2943.0 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半徑 | 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共價半徑 | 139±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 范德華半徑 | 217 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 雜項 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶體結構 | 四方 (白锡) 鑽石 (灰锡) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | (灰锡) 抗磁性[3], (白锡) 顺磁性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電阻率 | (0 °C)115 n Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熱導率 | 66.8 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 膨脹係數 | (25 °C)22.0 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
聲速(細棒) | (室溫)(rolled) 2730 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 楊氏模量 | 50 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 18 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 體積模量 | 58 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.36 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 1.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | ~350 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS號 | 7440-31-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最穩定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:锡的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
锡是一种化学元素,其化学符号是Sn(拉丁语Stannum的缩写),它的原子序数是50。它是一种主族金属。纯的锡有银灰色的金属光泽,它拥有良好的伸展性能,它在空气中不易氧化,它的多种合金有防腐蚀的性能,因此它常被用来作为其它金属的防腐层。锡的主要来源是它的一种氧化物矿物锡石(SnO2),盛產於中國雲南、馬來西亞等地。
目录
1 主要特征
1.1 物理特性
1.2 同素异形体
1.3 化學性質
1.4 同位素
2 用途
3 历史
4 来源
5 生理作用
6 註釋
7 參考資料
主要特征
物理特性

马来西亚皇家雪兰莪制作的锡製烛台
锡是一种可延展的、柔软的、高度结晶状的、银白色的金属。当锡棒被弯曲时,由于锡晶体是孪晶,可以听到被称之为锡鸣的爆裂声。[4]
锡在温度达到3.72K以下时成为超导体。[5]事实上,锡是最早被研究的超导体之一;超导体的特性之一——邁斯納效應,就是首先在锡晶体上发现的。[6]
同素异形体

左为银色的β锡,右为灰色的α锡
在常压下锡有2种同素异形体。以灰锡(α锡)、白锡(β锡)的状态存在。
在室溫,是常见的银白色金属白锡,富有延展性。白锡的晶体为正方晶结构,呈金属性,比重較灰錫重。当温度回降到低于13.2℃的话,它会慢慢变为粉末状的灰锡。灰锡的晶体结构是与钻石、硅和锗类似的鑽石型晶体结构。灰锡因为其原子间形成了共价结构,电子不能自由转移,故而没有任何金属性。灰锡是暗灰色的粉狀物,除了一些非常特殊的半导体应用,日常用途不大。[4]在低温下,白锡转化为灰锡的现象常被称为锡疫。[註 1]這個現象最早由亞里士多德發現,稱錫疫。未染上「锡疫」的锡板,一旦和有「锡疫」的锡板接触,也会产生灰色的斑点而逐渐「腐烂」掉。这个过程的轉化溫度會因存在杂质如铝和锌而降低。在锡中加入锑或铋可以防止锡的退化,促进锡的延展性。[8]這是由於铋原子中有多余的电子可供锡的结晶点阵,使錫的晶體結構稳定化,完全消除「锡疫」的可能性。
锡的另外两种合金γ锡和σ锡,只存在于温度高于161℃ (322℉)和压力大于几个GPa的环境中。[9]
化學性質
锡受水的锈蚀的影响很小,但易被酸和碱腐蚀。锡可以被高度的抛光,可被用作其他金属的保护层。[4]锡表面会形成保护性的氧化层以防止进一步的氧化。白锡和其他的锡合金表面都会形成这样的保护层。[10]当氧气存在于溶液中时,锡会变成一种催化剂,加速化学腐蚀。[4]
在空气中加热后锡可以形成SnO2。SnO2是弱酸性的。与熔融碱反应可以形成锡酸盐。它可以直接与氯和氧反应。在稀酸中它可以取代氢离子。
由於處於金屬和非金屬中間,同時具有兩者的特性。
- 作為金屬,可氧化至二價錫和較穩定的四價錫。
- 二價錫是兩性的,在酸中,可形成 [SnX3]−離子,X為F−,Cl−等;在鹼中,會形成[Sn(OH)3]−等離子。
- 四價錫也是兩性的,在酸中,可形成 [SnX6]2−離子,X為F−,Cl−等;在鹼中,會形成[Sn(OH)6]2−, [SnO3]2−等離子。四價錫的溶液都傾向水解出SnO2沉澱。
- 作為非金屬,錫可和碳,氧等非金屬組成份子。尤其是碳,可和錫形成很多有機錫化合物,應用很廣泛。
同位素
锡有9种稳定的同位素,是所有化学元素中稳定同位素最多的。此外锡还有28种不稳定同位素。
用途
锡很容易与铁结合,它被用来做铅、锌和钢的防腐层。涂锡的钢罐多用于贮藏食物,这是金属锡的一个重要市场。
其它用途:
- 锡是一些重要合金如青铜、巴氏合金等的组成部分。
氯化锡在印刷术中被用作一种还原剂和媒染剂。锡盐喷在玻璃上可以形成导电的涂层。这些涂层被用在防冻玻璃上。- 一般玻璃板是将熔化的玻璃浇在锡板上形成的,来保证玻璃面的平坦和光滑。
- 焊锡含锡用来连接管道和电子线路,此外锡还被用在多种化学反应中。
- 锡纸常用来包装食物或药品。
- 可镀于铜和铁上,镀锡的铁片称为马口铁;可防鏽、製作罐頭容器。
- 有機錫可作為有機化合物的合成的試劑,作用包括還原官能團、造成自由基及令有機份子重新排列。
在3.75K的低温下,锡晶體可成为超导体,也是最早被发现的超导体之一,超导体的一个特别特征迈斯纳效应便是首先在锡晶体中被发现。由于铌-锡-混合物(Nb3Sn)拥有较高的临界温度(18K)和较高的临界磁场(25特斯拉),它常被用来制作商用超导电磁铁的導线,一个数千克重的超导电磁铁可以产生一个数吨重的普通电磁铁所产生之磁场。
全球年锡用量约为30万吨,其中约35%用作焊锡,30%用为锡片和30%用为化学原料或颜色。由于越来越多的锡-铅-焊锡被无铅焊锡(含95%以上的锡)代替,全球的锡用量每年约提高10%。2003年在伦敦金属交易所,锡的价格为每吨五千美元左右,2004年的价格达每吨八千到一万美元。2003年世界上最大的十个用锡国家(或地区)为台灣、美国、日本、德国、其它欧洲国家总计、韩国、其它亚洲国家总计、英国和法国。
自1992年起,美国立法禁止包装产品中使用铅、汞、镉及六价铬这四种有毒金属。全球著名的红酒封套生产商拉蒙丁(RAMONDIN)公司便开始使用锡作为以上有毒金属的替代品,此种錫封套是当今红酒封套制造业中的领先技术且无法被輕易复制,因此成为保护红酒品牌及产品的一种有效途径。
历史
锡是人类知道最早的金属之一,从古代开始它就是青铜的组成部分之一。早在前36世纪锡就被用来硬化铜。约从前7世纪开始人类认识到纯的锡。於戰國時期就開始用來作武器的主要材料,無錫即以此命名,相傳無錫於戰國時期盛產錫,到了錫礦用盡之時,人們就以無錫來命名這地方,作為天下沒有戰爭的寄望。
今天有时锡这个词也被用在没有锡或只有很少锡的物体上。比如许多“锡纸”实际上是铝纸。大多数锡罐实际上是钢罐,上面涂有一层非常薄的锡。
来源
全世界约有35个国家产锡。几乎每个洲都有重要的产锡国。
在地壳中锡比较稀少,只占地壳的百万分之二,今天的锡矿的产量可能还可以维持约35年[來源請求]。80%锡矿是沉积岩,至少半数的锡来自东南亚(从中国中部经泰国到印度尼西亚)。
最重要得锡矿石是锡石(SnO2),锡矿中的原矿石含约5%的锡,首先矿石要被粉碎和用不同的方式提纯,提纯后的锡矿含75%的锡。在精炼炉中锡从其矿物中由碳还原出来。精炼炉中的温度稍低于锡的熔点,而杂质的熔点比这个温度要高,因此还原的锡可以从炉中流出。少量锡来自它的硫化物如圆柱锡石、硫银锡矿和硫锡铅矿等。越来越多的锡是回收来的。
台灣的锡产量占全世界的30%,其它东南亚国家一起占30%,南美洲占20%。
生理作用
金属锡即使大量也是无毒的,简单的锡化合物和锡盐的毒性相当低,但一些有机锡化物的毒性非常高。尤其锡的三烃基化合物被用作船的漆来杀死附在船身上的微生物和贝壳。这些化合物可以摧毁含硫的蛋白质。
註釋
.mw-parser-output .refbegin{font-size:90%;margin-bottom:0.5em}.mw-parser-output .refbegin-hanging-indents>ul{list-style-type:none;margin-left:0}.mw-parser-output .refbegin-hanging-indents>ul>li,.mw-parser-output .refbegin-hanging-indents>dl>dd{margin-left:0;padding-left:3.2em;text-indent:-3.2em;list-style:none}.mw-parser-output .refbegin-100{font-size:100%}
^ 这种转化被称为锡病或锡疫。锡疫在18世纪的北欧是一个特别的问题,因为管风琴的琴管是由锡合金制成,在漫长的冷冬有时会发生锡疫。有些来源说,在拿破仑的1812年的俄国战役时,由于温度太低以至于士兵们的军服上的锡纽扣都被冻坏,是他们战败原因之一。[7]
參考資料
^ SnH3. NIST Chemistry WebBook. National Institure of Standards and Technology. [23 January 2013].
^ HSn. NIST Chemistry WebBook. National Institute of Standards and Technology. [23 January 2013].
^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆的存檔,存档日期2012-01-12., in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
^ 4.04.14.24.3 Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils;. Tin. Lehrbuch der Anorganischen Chemie 91–100. Walter de Gruyter. 1985: 793–800. ISBN 3-11-007511-3 (德语). 引文使用过时参数coauthors (帮助)
^ Dehaas, W; Deboer, J; Vandenberg, G. The electrical resistance of cadmium, thallium and tin at low temperatures. Physica. 1935, 2: 453. Bibcode:1935Phy.....2..453D. doi:10.1016/S0031-8914(35)90114-8.
^ Meissner, W.; R. Ochsenfeld. Ein neuer effekt bei eintritt der supraleitfähigkeit. Naturwissenschaften. 1933, 21 (44): 787–788. Bibcode:1933NW.....21..787M. doi:10.1007/BF01504252. 引文使用过时参数coauthors (帮助)
^ Le Coureur, Penny; Burreson, Jay. Napoleon's Buttons: 17 Molecules that Changed History. New York: Penguin Group USA. 2004. 引文使用过时参数coauthors (帮助)
^ Schwartz, Mel. Tin and Alloys, Properties. Encyclopedia of Materials, Parts and Finishes 2nd. CRC Press. 2002. ISBN 1-56676-661-3.
^ Molodets, A. M.; Nabatov, S. S. Thermodynamic Potentials, Diagram of State, and Phase Transitions of Tin on Shock Compression. High Temperature. 2000, 38 (5): 715–721. doi:10.1007/BF02755923. 引文使用过时参数coauthors (帮助)
^ Craig, Bruce D; Anderson, David S; International, A.S.M. Handbook of corrosion data. 1995-01: 126. ISBN 978-0-87170-518-1.
元素周期表(主族金屬) | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| | IA 1 | IIA 2 | IIIB 3 | IVB 4 | VB 5 | VIB 6 | VIIB 7 | VIIIB 8 | VIIIB 9 | VIIIB 10 | IB 11 | IIB 12 | IIIA 13 | IVA 14 | VA 15 | VIA 16 | VIIA 17 | VIIIA 18 | ||||||||||||||||||
1 | H | | He | |||||||||||||||||||||||||||||||||
2 | Li | Be | | B | C | N | O | F | Ne | |||||||||||||||||||||||||||
3 | Na | Mg | | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||
4 | K | Ca | | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||
5 | Rb | Sr | | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||
6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||
7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||
| ||||||||||||||||||||||||||||||||||||
|