共价键

根据量子力学理论,共价键是由电子云重叠形成。如图所示,两个氢原子的1s电子云部分重叠,就形成了H-H共价键。
共价键(英语:Covalent Bond),是化学键的一种。两个或多个非金屬原子共同使用它们的外层电子(砷化鎵為例外),在理想情况下达到电子饱和的状态,由此组成比较稳定和坚固的化学结构叫做共价键。与离子键不同的是进入共价键的原子向外不显示电荷,因为它们并没有获得或损失电子。共价键的强度比氢键要强,比离子键小。同一種元素的原子或不同元素的原子都可以通過共價鍵結合,一般共價鍵結合的產物是分子,在少數情況下也可以形成晶體。
吉爾伯特·路易斯于1916年最先提出共价键。他提出在简单的原子轨道模型中进入共价键的原子互相提供单一的电子形成电子对,这些电子对围绕进入共价键的原子而属它们共有。
在量子力学中,最早的共价键形成的解释是由电子的复合而构成完整的轨道来解释的。第一个量子力学的共价键模型是1927年提出的,当时人们还只能计算最简单的共价键:氢气分子的共价键。今天的计算表明,当原子相互之间的距离非常近时,它们的电子轨道会相互作用而形成整个分子共用的电子轨道。
目录
1 吸引和排斥
2 电子饱和
3 键参数
4 例子
4.1 氧气分子
5 共价键的分类
6 极性共价键
7 网状共价键
8 配位键
9 參考文獻
10 外部連結
吸引和排斥
在共价键中,被共用的电子被所有进入共价键的原子吸引,由此使得这些原子结合在一起。虽然其原子核之间和电子之间會因电荷相同而互相排斥,但这些排斥作用被位于原子核间的电子减弱,而电子与原子核之间的相互作用更加强。

共用的电子受原子核的吸引(4绿线)
电子之间和原子核之间互相排斥(2红线)
电子饱和
按照简单的电子壳模型一个原子的外层电子在达到饱和状态下最稳定。对大多数原子来说,外层电子数为8时它们达到饱和,即“八隅體”。这时它们的外层电子数与同周期的惰性气体元素的外层电子数相同。
以氯化氢为例,在氯化氢分子中氢原子并没有将它的外层电子交给氯原子。而是两个原子共用一对外层电子而达到饱和状态。
键参数
键参数,是可以用於描述共价键性质的物理量的統稱,參數詳情可見於下列条目:
例子
氧气分子
氧原子的外层电子数为6,这六个电子中的四个组成两对,其它两个单独存在。
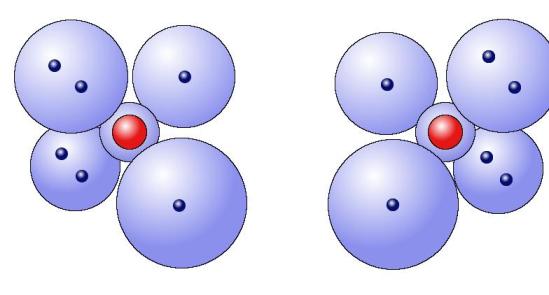
每个氧原子有六个外层电子
这两个单独的电子与另一个原子中相应的单独的电子结合组成两个新的共用的电子对,由此达到电子饱和的状态。
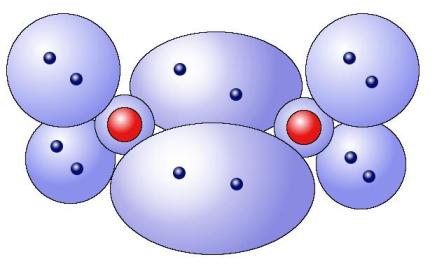
氧分子O2{displaystyle {ce {O2}}}
 的模型
的模型 注意:此處的氧分子模型是一个简化模型,实际上的氧分子要比这里描述的要复杂得多,因为这6个外层电子分布在不同的轨道上,所以它们不能形成这样简单的电子对。在实际之中,氧分子有3对共用的电子对和2个单独的电子。
共价键的分类
共价键是电子雲的重叠,所以共价键最本质的分类方式就是它们的重叠方式。现在已知有3种重叠方式,分别称作:
- σ键
- π键
- δ键
在有机化合物中,通常把共价键以其共用的电子对数分为單鍵、雙鍵以及叄鍵。单键是一根σ键;双键和叄鍵都含一根σ键,其余1根或2根是π键。
但无机化合物不用此法。原因是,无机化合物中经常出现的共轭体系(离域π键)使得某两个原子之间共用的电子对数很难确定,因此无机物中常取平均键级,作为键能的粗略标准。
极性共价键
假如组成共价键的原子的电负性不同,那么它们共用的电子对可能被其中的一个原子核吸引,由此而来它们在分子中的分布也不相等,电子被吸引比较集中的地方显负性,电子比较少集中的地方显正性。这样整个分子就会显示出一定的极性。一个分子的电极的分布除其原子的电负性外还与其分子的组成有关。
网状共价键
网状共价键,英文為Network covalent bonding,是原子晶体的主要化学键,是晶体结构的主要连接键。
网状共价键是共价键中的一种,它所形成的物质不是一个个的分子,而是一个大的原子晶体。网状共价键的连接之力很强,若想使键断开则需要有很大的能量,所以以网状共价键作为化学键的物质的熔点和沸点都较高、硬度也很大,最典型的例子之一就是金刚石。
配位键
配位键是一种特殊的共价键,它的特点在于共用的一对电子出自同一原子。形成配位键的条件是,一个原子有孤电子对,而另一个原子有空轨道。配位化合物,尤其是过渡金属配合物,种类繁多,用途广泛,现已形成配位化学。
參考文獻
.mw-parser-output .refbegin{font-size:90%;margin-bottom:0.5em}.mw-parser-output .refbegin-hanging-indents>ul{list-style-type:none;margin-left:0}.mw-parser-output .refbegin-hanging-indents>ul>li,.mw-parser-output .refbegin-hanging-indents>dl>dd{margin-left:0;padding-left:3.2em;text-indent:-3.2em;list-style:none}.mw-parser-output .refbegin-100{font-size:100%}
Covalent bonding — Single bonds. chemguide. 2000 [2012-02-05].
Electron Sharing and Covalent Bonds. Department of Chemistry University of Oxford. [2012-02-05].
Chemical Bonds. Department of Physics and Astronomy, Georgia State University. [2012-02-05].
外部連結
- Covalent Bonds and Molecular Structure
- Structure and Bonding in Chemistry—Covalent Bonds
| ||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||
|